 (資料圖片僅供參考)
(資料圖片僅供參考)
1、試題答案:(1)由于鋅比銅活潑,所以鋅作負極,所以消耗的金屬為鋅.鋅失電子生成鋅離子進入溶液。
2、電極反應式為鋅片:Zn-2e-=Zn 2+,銅片上氫離子得電子生成氫氣,所以電極反應式為:銅片:2H++2e-=H2↑.總反應:Zn+2H+=H2↑+Zn 2+ 65g 22.4L 9.75g 3.36L所以消耗金屬的質量為9.75g.故答案為9.75g.(2)Zn+2H+=H2↑+Zn2+轉移電子 22.4L 2mol 3.36L 0.3mol所以轉移電子的物質的量為0.3mol。
3、即1.806×1023個.故答案為1.806×1023個.(3)根據氫原子守恒,H+全部由H2SO4提供,所以n(H2)=n(H2SO4)=0.15molc(H2SO4)=0.15mol0.2L=0.75mol/L故答案為0.75mol/L.。
本文到此分享完畢,希望對大家有所幫助。




 中國無人駕駛技術初創公司文遠知行考慮IPO 最早于今年上市
中國無人駕駛技術初創公司文遠知行考慮IPO 最早于今年上市
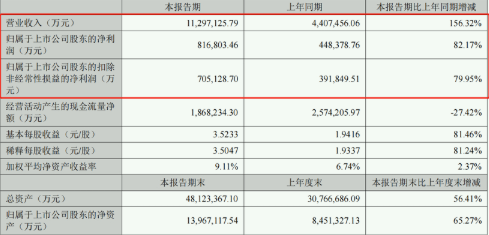 寧德時代上半年營業收入同比增156.32% 研發投入逼近同期凈利
寧德時代上半年營業收入同比增156.32% 研發投入逼近同期凈利
 蘭博基尼上半年業績創紀錄 上半年生產5090輛汽車
蘭博基尼上半年業績創紀錄 上半年生產5090輛汽車
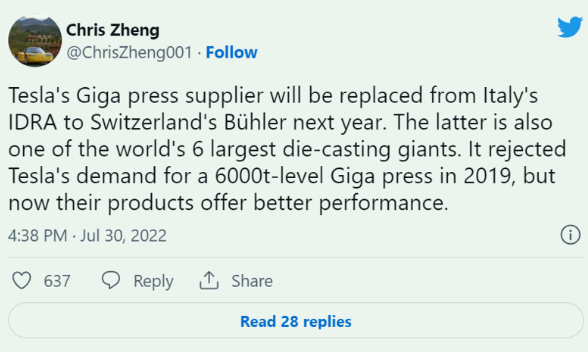 傳特斯拉或引入另一家壓鑄機供應商 不會取消與IDRA合作
傳特斯拉或引入另一家壓鑄機供應商 不會取消與IDRA合作
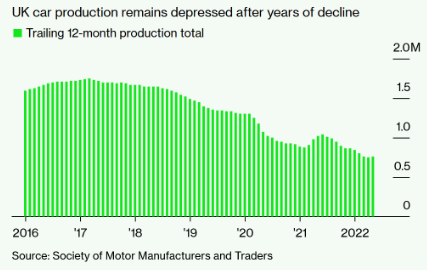 高油價有助于加速向電動汽車轉型 英國5月汽車產量同比增13%
高油價有助于加速向電動汽車轉型 英國5月汽車產量同比增13%